每日經濟新聞 2025-07-27 22:01:31
近日,勁方醫藥科技(上海)股份有限公司再次向港交所遞交招股書,公司核心產品GFH925面臨紅海競爭和專利挑戰。7月25日,維立志博-B登陸港交所,首日股價上漲超90%,雖仍在虧損但獲投資者關注。上周,康方生物依沃西單抗新適應證上市申請獲受理,針對晚期鱗狀非小細胞肺癌。《掘金創新藥》欄目持續解讀新藥研發進展。
每經記者|金喆 每經編輯|魏官紅

IPO觀察:勁方醫藥再次沖擊港交所上市
近日,勁方醫藥科技(上海)股份有限公司又一次向港交所發起沖刺。這是繼今年1月首次遞表后的重新提交,前次招股書已失效。
創始人呂強與蘭炯,一位是北大畢業、留美深造,曾在諾華和基石藥業擔任高管;另一位是蘭州大學博士、有恒瑞和揚子江工作背景的研發干將。他們于2017年攜手創立勁方醫藥,專注于腫瘤、自體免疫和炎癥性疾病領域的創新藥物開發。
招股書(申報稿)顯示,勁方醫藥核心產品GFH925是國內首個獲批的KRAS G12C抑制劑,已于去年8月上市。但該產品面臨激烈的紅海競爭,先發優勢并不明顯,今年前4個月的商品銷售收入僅為12.7萬元,且面臨多重專利挑戰。此外,勁方醫藥早在2021年便與信達生物就GFH925達成一項重量級合作,金額超10億元,但該項合作已于2024年1月終止,公司還需要向信達生物分期支付2000萬美元的不可退還終止費用。
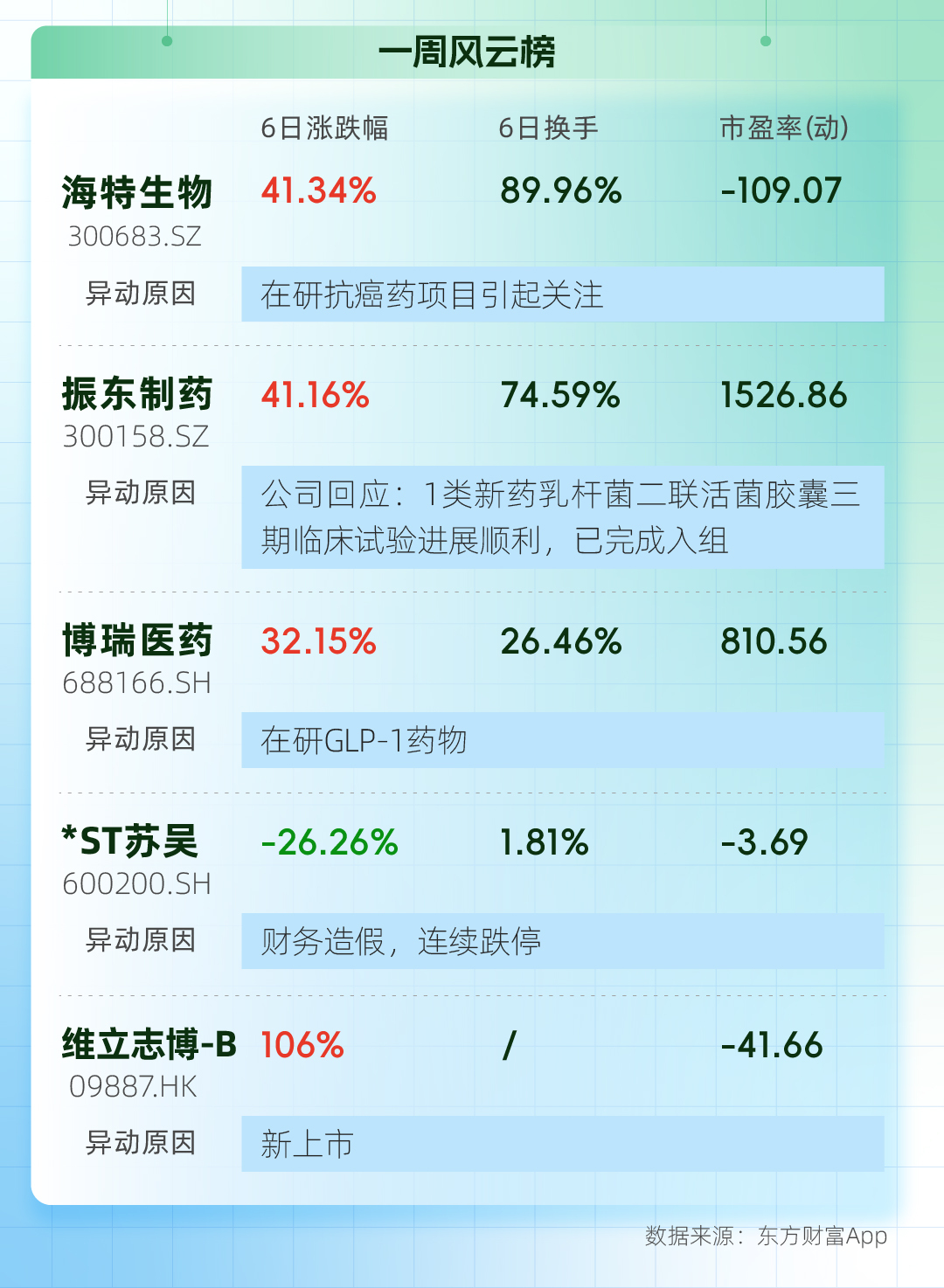
最受關注公司:獲約3495倍認購的維立志博-B上市首日上漲超90%
事件:7月25日,維立志博-B正式登陸港交所主板,首日股價上漲超90%,總市值達到近130億港元。
“趕得早不如趕得巧”,維立志博就趕上了創新藥板塊的好行情。創紀錄的認購數量,足以看出投資者對這家公司的關注。
與大多數剛上市的創新藥公司一樣,維立志博-B還在虧損、沒有產品上市,核心業務模式是自主發現、開發及商業化腫瘤免疫療法。截至目前,維立志博擁有1款核心產品LBL-024(PD-L1/4-1BB雙特異性抗體)及13款其他候選藥物,其中6款已成功進入臨床階段。
2023年、2024年及2025年前三個月,維立志博虧損額分別為3.62億元、3.01億元、7515萬元。期間,維立志博僅在2023年有約887萬元的收入,主要是根據百濟神州協議,就維立志博所提供的橋接研究服務而自百濟神州收取的款項。
《每日經濟新聞》記者在上市儀式現場看到,當港交所的大屏幕上出現維立志博-B的股價時,現場響起了陣陣歡呼聲與掌聲。
最受關注研發進展:康方生物明星藥物沖刺非小細胞肺癌第三項適應證
事件:7月25日,國家藥品監督管理局(NMPA)藥品審評中心(CDE)官網顯示,康方生物的依沃西單抗新適應證上市申請已獲受理。《每日經濟新聞》記者了解到,此次申報的適應證應為聯合化療一線治療晚期鱗狀非小細胞肺癌(sq-NSCLC)。
點評:肺癌是目前全球發病率和死亡率均排名第一的癌癥,非小細胞肺癌(NSCLC)約占肺癌病例的85%,其中晚期鱗狀非小細胞肺癌占比在20%~30%之間。康方生物依沃西單抗這一適應證申報上市,不論是對公司本身還是整個肺癌治療領域,都是一個積極的進展。
一線治療是癌癥治療中最初始、最關鍵的一步,其治療效果往往會影響整個治療過程的走向。就拿肺癌來說,當患者被確診為晚期非小細胞肺癌,還沒接受過針對這種癌癥的系統性治療時,醫生首先推薦使用的治療方案,就是一線治療。
在肺癌的免疫療法領域,非小細胞肺癌的一線治療是塊“大蛋糕”,占了整個免疫療法市場近一半的份額,是“兵家必爭之地”。拿到的一線治療適應證越多,這款藥物的話語權就越強。今年4月,康方生物披露過依沃西單抗這一適應證的臨床研究進展。在與百濟神州替雷利珠單抗聯合化療的“頭對頭研究”中,依沃西單抗獲得強陽性結果,更勝一籌。
如果這一適應證能夠獲批,sq-NSCLC患者就多了一個對抗癌癥的“武器”。對康方生物來說,則是公司發展的重要一步。非小細胞肺癌一線治療是免疫療法市場中的一塊“大蛋糕”,依沃西單抗若能在這個領域占據一席之地,無疑會給公司帶來可觀的市場份額,提升公司在行業內的競爭力。而且,這次申報是基于有強陽性結果的研究,也能進一步提升公司在研發和創新方面的口碑。
麗珠集團自身免疫藥物LZM012開展的Ⅲ期臨床試驗達到主要研究終點
事件:7月22日,麗珠集團宣布,公司1類創新生物藥LZM012用于中重度斑塊型銀屑病治療的Ⅲ期臨床試驗成功達到主要研究終點。該Ⅲ期臨床研究直接采用頭對頭研究設計,對標全球IL-17A靶點標桿藥物、諾華的“王牌產品”司庫奇尤單抗(商品名:可善挺)。2024年,可善挺全球銷售額達到61.41億美元。
自免與炎癥是腫瘤以外的第二大疾病領域。按全球存量患者數量來看,特應性皮炎、慢阻肺、哮喘、銀屑病都是全球發病人數超億人的大病。而且大多數自身免疫病屬于慢性病,目前仍未有完全治愈的藥物和手段,患者用藥時間長,存在巨大的需求空間。
有業內人士向《每日經濟新聞》記者表示,LZM012在Ⅲ期臨床試驗達到主要研究終點的更重要意義是,中國創新藥在自身免疫藥物領域的話語權越來越大。有了更好的臨床數據,這一藥物的BD(商務拓展)預期也會隨之提高。
羅氏終止早期減肥項目CT-173
事件:2023年12月,羅氏斥資27億美元收購Carmot Therapeutics公司,獲得了PYY類似物CT-173。該藥物模擬了腸道激素PYY,有助于促進胰島素分泌以響應血糖水平并調節食欲。今年4月份的第一季度財報中,羅氏仍計劃在今年啟動該藥物的I期臨床試驗。
羅氏于2024年9月公布的臨床前數據顯示,CT-173與GLP-1和GIP受體雙重激動劑CT-388聯合使用,有助于打破小鼠模型中的減肥平臺期。與單獨使用任何一種藥物相比,該藥物組合還能夠減緩停藥后體重反彈的速度。
在近日舉行的羅氏第二季度財報電話會議上,集團制藥部門首席執行官Teresa Graham表示,該分子未能達到羅氏公司評估是否值得進一步投資候選藥物的標準。
亞盛醫藥董事長楊大俊:研發難成藥的靶點堪比登珠峰,做創新藥更應避免內卷
2025年7月,亞盛醫藥的利沙托克拉(利生妥)獲國家藥監局附條件批準上市,成為國產原研首家、全球第2款Bcl-2抑制劑,打破艾伯維長達9年的壟斷。談到這款產品的成功上市,亞盛醫藥董事長楊大俊表示,創新藥應避免內卷,要做別人沒做過的事。
“me-too也好、快速跟進也好、生物類似藥也好,我一直說我們不做這類創新。這些在研發階段的風險比較小,但上市后的商業化風險更大,那時候(失敗的)成本更高。”楊大俊說,在信息發達的今天已經很難有“唯一、獨一、缺一不可”的品種,不管在什么樣的階段,亞盛的目標都是解決臨床無藥可用的困境。
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
